Même si l’image attachée aux cactées est celle de plantes massives et épineuses habitant des contrées arides et inhospitalières, beaucoup d’espèces dérogent à cette
règle.
Parmi les cactées, plusieurs genres ont opté pour les forêts plus ou moins humides d’Amérique du Sud et vivent en suspension au dessus du sol, accrochées aux
branches des arbres (cactées épiphytes) ou coincées en hauteur dans des rochers (cactées lithophytes), à la manière des orchidées et des broméliacées. Ces espèces épiphytes représentent 11 genres
avec environ 150 espèces (Hunt et al., 2006), soit environ 10 % des espèces de cactées, faisant de la famille un des groupes de plantes épiphytes les plus importants.
Ces cactées ont perdu une partie de la succulence qui caractérise la tige des cactées globulaires et colonnaires des milieux arides. Ces plantes se caractérisent
par de longues branches pas ou peu épineuses, généralement pendantes et ramifiées, et une exposition ombragée. Abreuvées par la pluie et agrippées par des racines spécialisées à des supports
assez organiques, elles ont des conditions de vies très différentes des cactées des milieux arides.
Dés le départ, et comme souvent en matière de taxonomie des cactées, la classification des cactées épiphytes a été très mouvementée, et elle reste encore loin
d’être stabilisée.
L’histoire mouvementée de la classification des cactées épiphytes
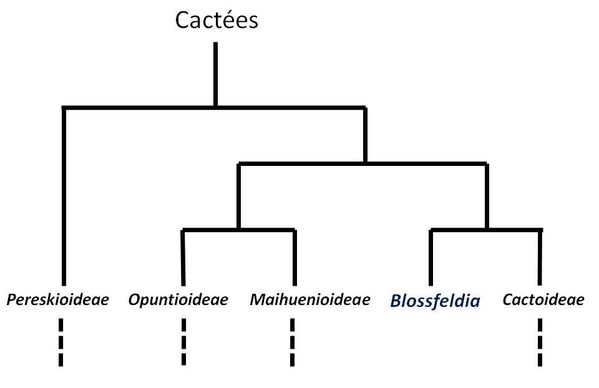
Les différents genres de cactées sont répartis au sein de 4 à 5 sous-familles, suivant les auteurs, et c’est la sous-famille Cactoideae qui est la plus
vaste (80% des espèces de cactées), regroupant les cactées globulaires, colonnaires et épiphytes. Elle est actuellement divisée en 9 tribus (Anderson, 2001) ou 7 tribus (New Cactus Lexicon, Hunt
et al., 2006). Les cactées épiphytes sont diverses et se répartissent actuellement dans plusieurs des tribus de la sous-famille Cactoideae.
Au sein des Cactoideae, une des tribus est d’une composition très particulière. Celle-ci regroupe uniquement des espèces épiphytes et lithophytes de
forêts tropicales et subtropicales humides : c’est la tribu des Rhipsalideae. Cette tribu a été assez bien définie par Barthlott et Taylor dans les années 1980 et 1990, puis revue et
affinée par Doweld en 2001. Les Rhipsalideae se présentent comme des cactées épiphytes aux aréoles quasiment dépourvues d’épines, et aux fleurs et fruits de taille réduite par rapport
aux autres cactées.
Une complication particulière de la classification des Rhipsalideae est que des genres ont fait la navette entre la tribu des Rhipsalideae et
celle des Hylocereeae, qui regroupe beaucoup d'espèces de cactées épiphytes. En 1970, Buxbaum avait d’ailleurs positionné les Rhipsalideae (alors appelés Rhipsalinae,
groupe au périmètre légèrement différent) comme un sous-groupe des Hylocereeae, avant qu’ils en soient détachés par Barthlott en 1987. En tout cas les 2 tribus sont considérées
comme très proches, les plantes des 2 groupes présentant de nombreux points communs et, surtout, une palette de caractères morphologiques qui sort du périmètre des caractères utilisés pour
définir chaque groupe. Le découpage des genres et sous-genres de cactées épiphytes reste très discuté et des ensembles de plantes sont passés des Rhipsalideae aux Hylocereeae
suivant les critères des auteurs. Bref, une grosse pagaille règne chez les cactées épiphytes.
|
La longue errance de Pfeiffera
|
|
 Les plantes du genre Pfeiffera présentent de longues tiges retombantes plates ou
côtelées, et de petites fleurs colorées ressemblant à celles des Rhipsalis ou des Hatiora (photo de gauche : Pfeiffera monacantha, anciennement
Acanthorhipsalis monacantha). Les plantes du genre Pfeiffera présentent de longues tiges retombantes plates ou
côtelées, et de petites fleurs colorées ressemblant à celles des Rhipsalis ou des Hatiora (photo de gauche : Pfeiffera monacantha, anciennement
Acanthorhipsalis monacantha).
Le genre Pfeiffera est sans doute celui qui a été le plus controversé et qui a le plus voyagé au sein de différents groupes taxonomiques, voici son
épopée :
- En 1899, Schumann classe l’actuel Pfeiffera monacantha sous Rhipsalis, dans le sous-genre Acanthorhipsalis.
- En 1923 Britton et Rose positionnent toutes les cactées épiphytes dans la tribu Cereeae et placent le genre Pfeiffera dans
la sous-tribu Rhipsalidanae. Trois espèces de Pfeiffera sont classées sous le nom de Acanthorhipsalis, qui acquiert le statut de genre.
- En 1970, Buxbaum positionne la sous-tribu Rhipsalidanae dans la tribu Hylocereeae, et crée la lignée Pfeifferae qui
contient les genres Pfeiffera et Acanthorhipsalis.
- Dans la classification de Endler et Buxbaum de 1974, Pfeiffera est dans la tribu Hylocereeae.
- Dans la classification de Gibson et Nobel de 1986, Pfeiffera est déplacé dans la tribu Notocacteae. Le genre est considéré comme
transitionnel entre Corryocactus et les autres membres de la tribu des Rhipsalideae.
- En 1987, Barthlott sépare les 2 tribus Rhipsalideae et Hylocereeae. Pfeiffera est dans la tribu
Rhipsalideae.
- Dans la classification de Barthlott et Hunt de 1993, Pfeiffera est dans la tribu Rhipsalideae.
- En 1995, dans la classification de Barthlott et Taylor, le taxon Pfeiffera n’était pas considéré comme un genre à part entière mais comme
un sous-genre de Lepismium, au sein des Rhipsalideae.
- En 2000, une étude moléculaire préliminaire de Nyffeler montre que Pfeiffera est plus proche des Corryocactus, aujourd’hui dans la
tribu des Echinocereeae, que des Lepismium.
- Dans la classification de Anderson de 2001, Pfeiffera reste dans la tribu Rhipsalideae.
- En 2001, Doweld a redéfini les 2 tribus Rhipsalideae et Hylocereeae de Barthlott et Taylor. Le taxon Pfeiffera a acquit
le statut de genre et a été transféré des Rhipsalideae aux Hylocereeae, à l’intérieur d’une sous-tribu, celle des Pfeifferinae, qui comprenait également les
Acantorhipsalis et les Lymanbensonia.
- L’étude moléculaire de Nyffeler de 2002, avec 3 espèces de Pfeiffera, a confirmé la classification des Rhipsalideae de Barthlott
et Taylor en 4 genres, à l’exception du genre Pfeiffera qui a été redéfini et également retiré des Rhipsalideae. L’étude montre que le placement des Pfeiffera
dans les Lepismium, comme le proposaient Barthlott et Taylor en 1995, constitue un groupe au mieux paraphylétique. Les Pfeiffera forment un groupe homogène localisé dans
un gros embranchement qui contient des Hylocereeae et des Echinocereeae.
- En 2006, Hunt et al. ont conservé la classification des Rhipsalideae de Barthlott et Taylor de 1995 mais, sur la base de l'étude
de Nyffeler, ont exclu les espèces Lepismium subg. Pfeiffera, Lepismium subg. Acanthorhipsalis, Lepismium subg. Lymanbensonia et une partie
des Lepismium subg. Houlletia de la tribu des Rhipsalideae pour les inclure dans le genre Pfeiffera au sein des Echinocereeae.
- En 2010, Nyffeler et Eggli définissent une grosse tribu, celle des Phyllocacteae, qui contient la sous-tribu Corryocactinae dans
laquelle se positionnent les Pfeiffera.
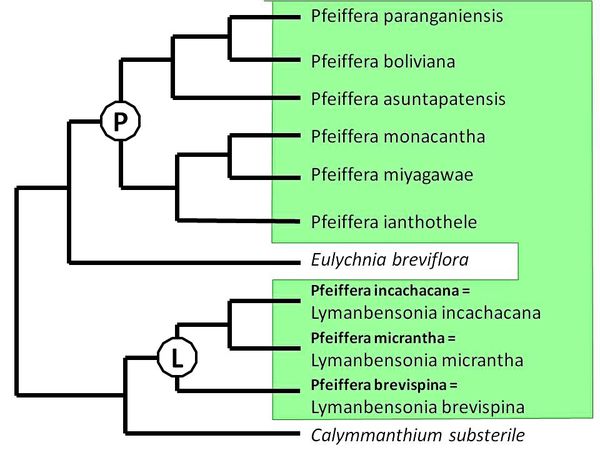
- Toujours en 2010, une grosse étude moléculaire analysant la presque totalité des espèces de Pfeiffera est publiée : coup de théâtre,
le genre est polyphylétique et constitué de 2 groupes distincts et très éloignés phylogénétiquement. Le premier groupe, qui conserve le nom de genre Pfeiffera sensu stricto, est
restreint à 6 espèces et divisé en 2 clades (clade Pfeiffera boliviana et clade Pfeiffera ianthothele). Etant donné que le second groupe contient Pfeiffera micrantha,
originellement considéré comme l’espèce type du genre Lymanbensonia, les auteurs proposent la réinstallation de ce second groupe sous le genre Lymanbensonia, à
l’intérieur d’une nouvelle tribu nommée Lymanbensonieae.

Schéma : cladogramme des Rhipsalideae, Hylocereeae,
Pfeiffera sensu stricto et Lymanbensonia, ainsi que de 2 genres proches de ces groupes, basé sur l’analyse bayésienne des marqueurs cytoplasmiques
trnK/matK.
|
Les rares études moléculaires, principalement celle de Nyffeler en 2002, ont confirmé que les tribus des Rhipsalideae et des Hylocereeae, même si
elles sont proches, représentent 2 lignées phylogénétiques distinctes. En ce qui concerne les Rhipsalideae, les plantes analysées par Nyffeler se regroupent bien ensembles sur les arbres
phylogénétiques construits (Rhipsalis floccosa, Lepismium cruciforme, Hatiora salicornoides et Schlumbergera truncata), à l’exception des Pfeiffera (Pfeiffera monacantha,
Pfeiffera ianthoyhele et Pfeiffera miyagawae) qui forment un groupe homogène hors de la tribu. En ce qui concerne la tribu des Hylocereeae, l’homogénéité du groupe semble
plus problématique, et elle est fortement liée aux Echinocereeae, et à d’autres tribus. En 2006 (Hunt et al.), les cactées épiphytes ont été réparties dans 3 tribus : les
Rhipsalideae, les Hylocereeae et les Echinocereeae.
Dans leur synthèse de 2010, qui fait le point sur toutes les études moléculaires sur la famille des cactées, Nyffeler et Eggli définissent une grosse tribu
Phyllocacteae qui rassemble des plantes de plusieurs anciennes tribus et qui se découpe en 3 sous-tribus : Corryocactinae, Hylocereinae et Echinocereinae.
La sous-tribu Hylocereinae est conforme à la tribu Hylocereeae (Anderson, 2005), à l’exception de certaines espèces de Selenicereus qui ont été exclues et transférées
dans les Strophocactus, eux même dans la tribu traditionnelle des Echinocereeae. Toutes les plantes de cette sous-tribu Hylocereinae sont des épiphytes, la plupart avec
de grosses fleurs nocturnes sphingophiles, sauf certains Disocactus avec des fleurs diurnes et colorées pollinisées par les oiseaux.
La tribu des Rhipsalideae
Du fait des multiples analyses moléculaires qui ont confirmé la délimitation de la tribu des Rhipsalideae, celle-ci est maintenant bien définie et fait une
relative unanimité chez les auteurs. Cependant, la tribu reste à géométrie variable et quelques espèces voyagent d’un genre à l’autre au sein de la tribu suivant les avis des uns et des autres.
Les 4 genres que l'on trouve dans les Rhipsalideae, suivant la classification de Barthlott et Taylor de 1995 reprise et modifiée par Hunt et al. (New Cactus Lexicon
2006), sont donc :
 ● Schlumbergera : plante bien connue par le célèbre et classique
Zygocactus des grand-mères (photo de droite : Schlumbergera truncata). De culture facile, la plante se présente comme une grosse touffe de branches acrotoniques vertes
sombres, semi-érigées, très segmentées et ramifiées, aux articles glabres, larges, plats et courts. De très loin la plus cultivée des cactées épiphytes, elle illumine en hiver ou au printemps les
intérieurs d’une profusion de fleurs terminales et pendulaires, colorées, souvent roses, actinomorphes ou zygomorphes. Le tube floral est plus ou moins présent, avec les éléments du périanthe
fins et pointus. Dans son habitat les fleurs sont pollinisées par les oiseaux.
● Schlumbergera : plante bien connue par le célèbre et classique
Zygocactus des grand-mères (photo de droite : Schlumbergera truncata). De culture facile, la plante se présente comme une grosse touffe de branches acrotoniques vertes
sombres, semi-érigées, très segmentées et ramifiées, aux articles glabres, larges, plats et courts. De très loin la plus cultivée des cactées épiphytes, elle illumine en hiver ou au printemps les
intérieurs d’une profusion de fleurs terminales et pendulaires, colorées, souvent roses, actinomorphes ou zygomorphes. Le tube floral est plus ou moins présent, avec les éléments du périanthe
fins et pointus. Dans son habitat les fleurs sont pollinisées par les oiseaux.
Les hybrides horticoles des espèces botaniques sont nombreux et répandus, et seul le plus rare S. opuntioides présente des difficultés de culture pour le
néophyte. A première vue le genre semble assez simple et bien défini, au point que Barthlott et Taylor n’ont crée aucun sous-genre, tandis que Hunt et al. l’ont divisé en 2
groupes : l’un correspondant aux cactus de Noël et l’autre aux Epiphyllanthus, qui se différencient principalement par le dernier segment des tiges et ses aréoles.
● Hatiora : genre qui ne fait pas l’unanimité et dont les espèces voyagent entre Rhipsalis et
Hatiora suivant les auteurs. Dans ce genre Barthlott et Taylor ont placé les sous-genres Hatiora et Rhipsalidopsis.
Les plantes sont assez variables suivant les espèces. Les tiges acrotoniques, souvent minces, peuvent être pendantes ou érigées, mais toujours très ramifiées. Elles
sont cylindriques, plates, en massue ou côtelées. Elles sont glabres et avec une segmentation bien visible. Les fleurs actinomorphes, érigées ou pendulaires, sont très colorées. Le tube floral
est court ou réduit, avec des éléments du périanthe plutôt courts.
 ● Rhipsalis : genre
confus et très découpé. Les sous-genres Rhipsalis, Erytrorhipsalis, Calamorhipsalis, Epallagogonium et Phyllarthrorhipsalis ont été inclus dans le genre par Barthlott et Taylor
et ont été conservés par Hunt et al. en 2006.
● Rhipsalis : genre
confus et très découpé. Les sous-genres Rhipsalis, Erytrorhipsalis, Calamorhipsalis, Epallagogonium et Phyllarthrorhipsalis ont été inclus dans le genre par Barthlott et Taylor
et ont été conservés par Hunt et al. en 2006.
Les plantes sont très variables suivant les nombreuses espèces du genre (photo de droite : Rhipsalis heteroclada). Les tiges acrotoniques ou mésotoniques, souvent minces, peuvent être pendantes ou érigées, de pas du tout à très ramifiées, plates, cylindriques ou côtelées. Elles peuvent
être totalement linéaires ou d’apparences très segmentée (même s'ils ne sont pas toujours visibles, les segments sont long (> 7cm) et bien présent). Les tiges varient suivant les espèces d’une
apparence totalement glabre à pubescente. Les petites fleurs actinomorphes, latérales ou terminales, sont généralement ternes, plus rarement colorées. Cette multitude de caractères explique les
multiples sous-genres.
● Lepismium : Genre proche des Rhipsalis et dont le nombre d’espèces est également assez variable suivant
les auteurs. Suite aux travaux de Nyffeler, en 2006 Hunt et al. ont fortement réduit le genre Lepismium : les sous-genres Pfeiffera, Acanthorhipsalis,
Lymanbensonia et Houlletia qui avaient été définis par Barthlott et Taylor ont été exclus des Rhipsalideae et placés dans les Echinocereeae, à l’intérieur du genre
Pfeiffera.
Les plantes se présentent comme des touffes de longues tiges pendantes, mésotoniques, plates ou côtelées, ou cylindriques chez L. lumbricoides. Elles sont
peu ou pas ramifiées. La segmentation est peu ou pas déterminée. Les petites fleurs latérales et actinomorphes, ternes, apparaissent dans les creux souvent échancrés des aréoles, parfois
légèrement laineuses.
La première analyse moléculaire d’envergure des Rhipsalideae
Du fait des fortes ressemblances entre de nombreux genres et espèces de cactées épiphytes qui brouillent la classification de ces plantes, un groupe de biologistes
(Calvente et al.) a entrepris une vaste étude de génétique moléculaire des Rhipsalideae de manière à clarifier la taxonomie de la tribu. Les résultats de cette étude ont été
publiés en 2011. Les chercheurs ont étudié 35 des 55 espèces décrites au sein des Rhipsalideae (Hunt et al., 2006), soit 63% des espèces du groupe, ainsi que 4 espèces
issues d'autres tribus pour établir une base de comparaison.
Leur étude est allée plus loin que la simple cladistique des cactées épiphytes : à partir de la classification phylogénétique obtenue ils ont essayé de
faire une corrélation avec les caractères morphologiques des plantes, et de définir à quoi pouvait ressembler l’ancêtre des Rhipsalideae.
|
L’étude est basée sur les comparaisons des séquences de 4 marqueurs génétiques : les 3 séquences chloroplastique trnQ-rps16,
rpl32-trnL et psbA-trnH, ainsi que la séquence nucléaire ITS. Ces marqueurs ont été sélectionnés au sein d’une série de 13 marqueurs chloroplastiques,
nucléaires ou mitochondriaux qui ont été préalablement testés pour leur utilité dans la classification de ce groupe de plantes.
Rappelons que les chloroplastes sont des organites cytoplasmiques de transmission maternelle exclusive, leurs génomes ne subissent donc pas de recombinaison
au moment de la méiose, à la différence du génome nucléaire, ce qui les rends très utiles pour des analyses phylogénétiques.
Les constructions des arbres phylogénétiques avec les différentes espèces de cactées étudiées ont été effectuées à partir d’analyses de maximum de
parcimonie, d’analyses de probabilité et d’analyses bayésiennes des séquences d’ADN alignées manuellement.
- L’analyse de parcimonie (ou maximum de parcimonie), ainsi que l’analyse de probabilité, permettent de construire un arbre phylogénétique qui
requiert le plus petit nombre possible de changements génétiques pour passer d’une branche à l’autre, c'est-à-dire un arbre de moindre coûts (ou optimal) en matière « d’efforts
évolutifs ». C’est la méthode principale en matière d’inférences phylogénétiques.
- L’analyse bayésienne (ou inférence bayésienne) part de quelques suppositions ou probabilités statistiques posées au départ sur les similarités des
séquences génétiques, ces suppositions sont ensuite testées, révisées et affinées progressivement en utilisant de plus en plus de données génétiques disponibles.
Dans cette étude, une analyse bayésienne particulière a également été effectuée avec une contrainte qui forçait toutes les espèces assignées au genre
Hatiora à former un groupe monophylétique, pour tester cette hypothèse de monophylie par rapport aux résultats qui montraient un éclatement du groupe en cas d’analyse non
contrainte.
|
Les analyses séparées des 3 séquences chloroplastiques permettent d’aboutir à des résultats similaires, où seul varie le niveau de résolution dans le découpage des
différents clades. Du fait de cette congruence dans les résultats des analyses séparées des séquences chloroplastiques, celles-ci ont été largement analysées en combinaison.
L’analyse phylogénétique des données obtenues à partir du marqueur nucléaire ITS est peu concluante et montre une absence de congruence fine avec les
données obtenues avec les marqueurs cytoplasmiques, aussi bien analysées séparément que combinées. De plus, quelques contradictions sont notées entre les arbres « cytoplasmiques » et
« nucléaires », principalement au niveau de 5 espèces de Rhipsalis. Les raisons possibles des divergences entre données nucléaires / cytoplasmiques (recombinaison, paralogie,
hybridation et introgression) ne sont pas discutées ici. Les grands groupes taxonomiques révélés avec les données nucléaires sont cependant en accord avec ceux révélés par les données
cytoplasmiques.
Toutes les analyses moléculaires chloroplastiques confirment la monophylie de la tribu Rhipsalideae et sa division en 4 genres. L’analyse des séquences
chloroplastiques fait émerger 2 clades majeurs au sein des Rhipsalideae :
-
● un gros clade fortement étayé incluant toutes les espèces de Rhipsalis.
Dans ce clade regroupant les Rhipsalis une large polytomie est cependant obtenue avec le marqueur trnQ-rps16, et le marqueur psbA-trnH
fait apparaitre une division en plusieurs petits clades à l’intérieur du groupe des Rhipsalis. Le clade Rhipsalis peut être divisé en 4 groupes dont 2 transgressent les
divisions en sous-genres précédemment établies. Seuls les sous-genres Calamorhipsalis et Erythrorhipsalis sont chacun monophylétiques et peuvent constituer chacun un
groupe.
Une seconde étude des mêmes auteurs, publiée en 2011 et axée uniquement sur les Rhipsalis, a affiné ces résultats : les Rhipsalis constituent un
groupe hautement monophylétique mais les sous-genres Epallagogonium et Rhipsalis sont paraphylétiques. Dans cette analyse 3 groupes principaux sont retrouvés au sein du genre
Rhipsalis : un clade au péricarpe creux, un clade constitué des Erythrorhipsalis et un dernier constitué par le sous-genre Rhipsalis.
-
● un petit clade faiblement étayé regroupant les 3 genres restant de la tribu : Schlumbergera, Hatiora et
Lepismium.
Dans ce clade, la monophylie de Lepismium est fortement confirmée alors que Schlumbergera et Hatiora sont paraphylétiques. A l’intérieur
de Lepismium le sous-genre Houlletia apparait comme paraphylétique. Trois espèces de Hatiora forment un groupe homogène bien étayé, nommé ici Hatiora sensu
stricto ou Hatiora subgenus Hatiora. Le clade Schlumbergera inclut à la fois des espèces de Schlumbergera et de Hatiora subgenus Rhipsalidopsis. Ce clade
Hatiora subgenus Rhipsalidopsis est paraphylétique, avec H. rosea et H. gaertneri regroupés ensembles alors que H. epiphylloides apparait comme une
espèce sœur des Schlumbergera.

Schéma : cladogramme simplifié des Rhipsalideae basé sur l’analyse bayésienne des marqueurs
cytoplasmiques. La localisation géographique des taxons est indiquée sur la droite. Chez les Rhipsalis le groupe floccosa contient : R. dissimilis, R. floccosa et R.
trigona. Chez les Schlumbergera, en plus des plantes classiquement inféodées au genre, le groupe contient les Hatiora suivant : H. rosea, H. gaertneri et
H. epiphylloides.
L’analyse effectuée avec une contrainte qui force toutes les espèces assignées au genre Hatiora à former un groupe monophylétique produit un arbre assez
différent des analyses non contraintes, qui produisent un arbre dans lequel les espèces du genre Hatiora forment 3 lignées indépendantes.
Il y a donc nécessité de revoir la classification actuelle des genres Schlumbergera et Hatiora, qui se révèlent paraphylétiques.
La classification actuelle, issue de celle de Barthlott en 1987, a séparé les Hatiora des Schlumbergera sur la base de la zygomorphie des fleurs de ces derniers, hors ce
caractère s’avère être homoplastique, avec une évolution parallèle de la zygomorphie dans plusieurs lignées indépendantes : la zygomorphie n’est donc pas adéquate pour une assignation des
plantes à un genre. Les auteurs proposent donc de transférer les espèces appartenant à Hatiora subg. Rhipsalidopsis vers le genre Schlumbergera, ce qui réduit le genre
Hatiora à seulement 3 espèces (Hatiora sensu stricto) : H. cylindrica, H. herminiae et H. salicornioides.
Toutes les espèces de Hatiora subg. Rhipsalidopsis et Schlumbergera regroupées dans un genre commun sont similaires au niveau végétatif et
caractérisées par des segments de tiges courtes, plates (à doubles ailes) et à croissance déterminées (ou à tiges côtelés chez S. microsphaerica), tandis que Hatiora sensu stricto
(Hatiora subg. Hatiora) a des segments de tige cylindriques. Un autre critère permet de différencier le genre Hatiora s. str. du nouveau groupe élargi des
Schlumbergera : alors que les espèces de ce dernier groupe ont des tiges et des fleurs généralement pendulaires, un périanthe avec un grand nombre de segments et des pointes aigües
ou apiculées, le genre Hatiora s. str. présente des tiges et des fleurs généralement érigées, un périanthe qui comporte moins de segments et avec des pointes obtuses.

Schéma : cladogramme des genres Hatiora sensus stricto (Hatiora subg. Hatiora) et
Schlumbergera basé sur l’analyse bayésienne des marqueurs cytoplasmiques.
Les résultats de l’étude indiquent que certains caractères morphologiques traditionnellement utilisés pour classifier les Rhipsalideae sont homoplastiques
et ne sont pas adéquats pour définir les différents genres, par exemple la zygomorphie et l’apparence du tube floral, caractères qui sont pourtant au centre de la classification des
angiospermes.
A l’opposé, certains caractères morphologiques sont de bons outils de classification des genres : la structure du branchage et la croissance des tiges sont utiles
pour la classification de Lepismium (mésotonique et indéterminée) versus Hatiora et Schlumbergera (acrotonique et déterminée). Par contre ces caractères sont
inutilisables chez Rhipsalis. La forme de la tige permet également de différencier Schlumbergera de Hatiora s. str, et la couleur des fleurs permet la séparation de
Lepismium et Rhipsalis versus Hatiora et Schlumbergera.
En ce qui concerne les Rhipsalis, il est très difficile de trouver des synapomorphies à l’intérieur du genre : ceci laisse penser que l’évolution des
Rhipsalis a été importante et complexe.
Suite à leur étude, les auteurs proposent un algorithme pour l’identification des différents taxons :
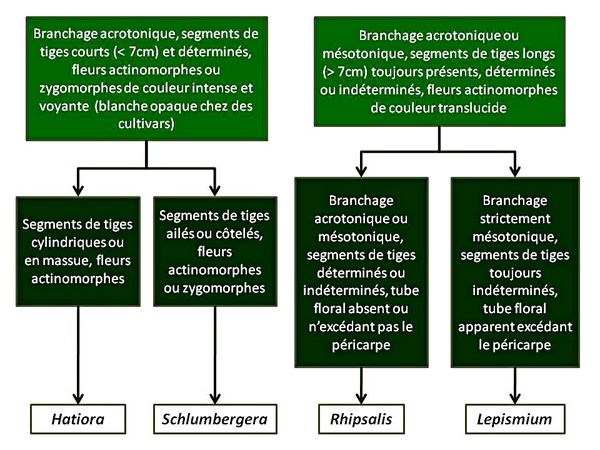
En 2010, une étude phylogénétique a montré qu’un groupe d’espèces du genre Pfeiffera inclut en son sein une espèce habituellement enregistrée sous le genre
Lepismium : il s’agit de Lepismium incachacanum. C’est une plante bolivienne avec des tiges plates et larges, ramifiées, retombantes ou érigées. Elle se caractérise par des
touffes de poils jaunes ou bronze hérissés qui jaillissent des aréoles très crénelées. Les petites fleurs sont rouges à violet-pourpre.
Hélas cette espèce de Lepismium n’avait pas été utilisée dans l’étude sur les Rhipsalideae publiée en 2011. Il s’avère donc que cette
espèce doit être sortie de la tribu des Rhipsalideae, et les auteurs proposent de renommer Lepismium incachacanum en Lymanbensonia incachacana du fait que le groupe
auquel elle appartient contient l’espèce type de l’ancien genre Lymanbensonia. Ce groupe est placé au sein d’une nouvelle tribu nommée Lymanbensonieae. Les caractéristiques de
la plante sont cohérentes avec l’ancien genre Lymanbensonia, surtout du fait des fleurs très colorées à périanthe à peine élargi.
Les ancêtres des cactées épiphytes
La présence d’espèces de Rhipsalis en Afrique tropicale, Madagascar et Sri Lanka avait conduit certains auteurs à penser que cette distribution était le
signe d’une vieille vicariance entre Amérique du Sud et Afrique (par exemple Backeberg en 1942), ou même l’indication d’une origine des cactées hors de l’Amérique (Croizat, 1952). Cela
impliquerait une origine des cactées antérieure à la période du crétacé tardif, avant la séparation de l’Amérique et de l’Afrique, et que toutes les cactées africaines aient ensuite disparues, à
l’exception des Rhipsalis. D’autre part, la similitude des Rhipsalis de l’ancien et du nouveau monde impliquerait que ces plantes constituent des cactées ancestrales, ou bien
une évolution fortement convergente des taxons de Rhipsalis des 2 continents.
Des études suggèrent cependant que l’origine des cactées est plus récente que le crétacé tardif et se place au tertiaire moyen, et se situe dans le nord de
l’Amérique du Sud, après le partage du Gondwana. De plus, la large distribution de Rhipsalis baccifera serait due à une ou plusieurs dispersions récentes des graines par les oiseaux du
nouveau vers l’ancien monde (Gibson et Nobel, 1986 ; Barthlott et Hunt, 1993).
Les études moléculaires, notamment celle de Nyffeler en 2002, ont montré que le caractère épiphyte des cactées est hautement dérivé : même si elles sont
réunies en groupes taxonomiques, les cactées épiphytes sont mélangées au sein des cladogrammes avec des espèces de milieux plus ou moins arides qui n’ont aucun caractère épiphyte.
La tribu des Echinocereeae comporte essentiellement des genres terrestres mais aussi un genre épiphyte, Pfeiffera, apparenté aux Corryocactus.
Nyffeler a montré que cette tribu est fortement liée, voire intriquée, à la tribu des Hylocereeae, qui contient un assemblage de plantes grimpantes et épiphytes sous forme d’un continuum
dans lequel on passe graduellement d’espèces complètement terrestres à des espèces totalement épiphytes (Epiphyllum, Disocactus et Pseudorhipsalis).
Tout montre que le caractère épiphyte des cactées est un attribut d’apparition récente, et qui a évolué indépendamment chez plusieurs lignées distinctes de plantes
succulentes, possiblement de cactées colonnaires côtelés ou des plantes grimpantes, et poussant à l’origine dans des milieux semi-arides et relativement boisés. Ces plantes auraient subies des
modifications structurales au cours du temps : développement de racines adventices, développement de tiges en forme de feuilles, réduction de la taille des côtes et du diamètre des tiges, pertes
des structures et tissus internes permettant un port érigé, et réduction ou perte de la spination.
Si 2 lignées épiphytes ont été vite identifiées chez les Rhipsalideae et des Hylocereeae, le genre Pfeiffera a ensuite semblé être issu d’une
3ème lignée à la suite des travaux de Nyffeler de 2002. Cependant ce genre doit être divisé en 2 groupes distincts (Pfeiffera et Lymanbensonia) suite aux travaux de
Korotkova publiés en 2010, et on considère aujourd’hui qu’il existe donc au moins 4 lignées indépendantes de cactées épiphytes :
-
- Rhipsalideae
-
- Lignée au sein des Hylocereeae
-
- Pfeiffera
-
- Lymanbensonia
La distribution des différents genres épiphytes en Amérique du sud est variée, avec des habitats isolés ou qui se chevauchent. Les Rhipsalideae ont leur
centre de distribution dans le sud-ouest du Brésil, tout en s’étendant vers le Paraguay, le nord de l’Argentine et l’est des Andes boliviennes, alors que ni Pfeiffera sensu stricto ni
Lymanbensonia n’existent au Brésil. Il est possible de penser que les Rhipsalideae ont vu le jour au Brésil et ont gagné les Andes par la suite, alors que Pfeiffera sensu
stricto, qui est distribué de l’est des Andes boliviennes au nord de l’Argentine, et Lymanbensonia, qui est distribué du sud de l’Equateur au sud Pérou et l’est des Andes
boliviennes, ont évolué dans les Andes boliviennes et au Pérou. Enfin la lignée épiphyte des Hylocereeae serait d’origine mésoaméricaine.
Même si elles vivent dans des milieux beaucoup plus humides que les plantes succulentes terrestres, les cactées épiphytes ont gardé une partie du caractère
succulent de leurs ancêtres, ce qui leur permet de résister à une relative sécheresse en dehors des périodes de pluie, et qui a sans doute facilité leur évolution sur des positions en hauteur,
parfois sèches, avec peu ou pas de substrat : la succulence est sans doute l’explication de la multiplicité d’apparitions de lignées de plantes épiphytes au sein des cactées.
 Les
similarités morphologiques retrouvées entre beaucoup de cactées épiphytes ont totalement brouillé la classification. Elles résultent de très fortes convergences évolutives, qui ont amené des
plantes de lignées très distinctes à présenter des apparences très similaires, à tous les niveaux, et qui montrent qu’une classification basée sur quelques caractères morphologiques n’est pas
possible. Cette convergence évolutive est extrême pour les Lymanbensonia et Pfeiffera sensu stricto, où des plantes de 2 lignées très distinctes ont été pendant longtemps
assimilées à un même genre, alors que l’espèce Lymanbensonia incachacana est incluse dans les Lepismium (Lepismium incachacanum), tel que l’a montrée l’étude de
Korotkova et al.
Les
similarités morphologiques retrouvées entre beaucoup de cactées épiphytes ont totalement brouillé la classification. Elles résultent de très fortes convergences évolutives, qui ont amené des
plantes de lignées très distinctes à présenter des apparences très similaires, à tous les niveaux, et qui montrent qu’une classification basée sur quelques caractères morphologiques n’est pas
possible. Cette convergence évolutive est extrême pour les Lymanbensonia et Pfeiffera sensu stricto, où des plantes de 2 lignées très distinctes ont été pendant longtemps
assimilées à un même genre, alors que l’espèce Lymanbensonia incachacana est incluse dans les Lepismium (Lepismium incachacanum), tel que l’a montrée l’étude de
Korotkova et al.
Chez les cactées épiphytes l’évolution produit un aplatissement ou un amincissement des tiges du fait d’une perte des côtes, et cette perte des côtes qui empêche le
support mécanique des tiges provoque leur affaissement et une position pendante. Un glissement vers la pollinisation par des insectes ou des oiseaux, ainsi que la production de fruits dispersés
par les oiseaux, sont aussi considérés comme des convergences évolutives chez toutes les cactées épiphytes. Une convergence évolutive semble toujours associée à l’épiphytisme, y compris en dehors
de la famille des cactées.
Dans le cladogramme mêlant Echinocereeae et Hylocereeae il reste possible que des lignées de plantes épiphytes aient subit une réversion pour
redevenir des espèces succulentes terrestres (par exemple la question peut être posée dans les genres Pfeiffera, Selenicereus ou Weberocereus). Même si cela reste moins
probable, les réversions évolutives sont des phénomènes couramment observés en biologie. Les Corryocactus, incluant Erdisia et Eulychnia, sont relativement proches de
Pfeiffera, et les séparations entre ces genres ont encore besoin d’être évaluées.
La tribu des Rhipsalideae (photo ci-dessus à gauche : Lepismium houlletianum) constitue un cas à part car, à la différence des autres tribus, elle est composée uniquement de plantes épiphytes et elle forme un cladogramme très isolé des autres tribus
: tout laisse penser que l’ancêtre de la tribu des Rhipsalideae était une cactée épiphyte.
A la recherche de l’ancêtre des Rhipsalideae
En se basant sur les arbres phylogénétiques obtenus avec les espèces de la tribu des Rhipsalideae, les auteurs de l’article de 2011 ont essayé d’en déduire
l’apparence de l’ancêtre des Rhipsalideae à partir de 6 caractères morphologiques appliqués sur les cladogrammes. Ces caractères sont :
- La symétrie florale : actinomorphe / zygomorphe
- Le tube floral : apparent / non apparent / équivoque
- La structure des branches : mésotonique / acrotonique / incertaine
- La croissance de la tige : indéterminée / déterminée / incertaine / équivoque
- La forme de la tige : ailée (plate) ou côtelée (angulaire) / cylindrique / équivoque
- La couleur des fleurs : intense et voyante / translucide
● Tous les résultats indiquent que les fleurs actinomorphes sont un caractère ancestral dans la tribu. La zygomorphie est d’apparition plus récente
et serait apparue au moins 2 fois indépendamment dans 2 lignées de Schlumbergera d’après l’analyse de parcimonie. Par contre l’analyse bayésienne suggère une seule apparition de la
zygomorphie chez l’ancêtre commun de S. opuntioides, S. russeliana, S. orssichiana, S. truncata et H. epiphylloides, suivie par 2 réversions vers des fleurs actinomorphes chez
S. russeliana et H. epiphylloides.
● D’après toutes les analyses statistiques le tube floral non apparent et n’excédant pas le péricarpe représente le caractère ancestral de la
tribu. Un allongement du tube floral au dessus du péricarpe est ensuite apparu chez les Lepismium. Le reste est moins sûr : un allongement du tube floral également chez
Schlumbergera suivi par un raccourcissement chez certains Hatiora, ou bien 2 allongements indépendants du tube floral chez 2 lignées de Schlumbergera.
● Le branchage acrotonique constitue la condition de l’ancêtre de la tribu. Puis un branchage mésotonique est apparu chez les Lepismium et
3 autres apparitions de branchages mésotoniques chez 3 espèces de Rhipsalis.
● Alors que l’analyse de parcimonie n’est pas concluante, l’analyse bayésienne indique que la croissance déterminée de la tige est le caractère
ancestral de la tribu. Des transitions vers une croissance indéterminée ont ensuite eu lieu chez Lepismium et Rhipsalis. Chez ce dernier genre une succession de réversions vers
des croissances déterminées et indéterminées auraient eu lieu suivant les espèces.
●  En ce qui concerne la forme ancestrale de la tige, l’analyse de parcimonie indique que la forme cylindrique était celle de l’ancêtre de la tribu, suivie par au moins 5
réversions vers des formes côtelées ou ailées. Par contre l’analyse bayésienne indique que la forme côtelée ou ailée des tiges était celle de l’ancêtre de la tribu, suivie par 3 réversions vers
des formes cylindriques chez Hatiora, Lepismium lumbricoides et Rhipsalis, avec pour ce dernier genre 3 nouvelles réversions successives vers des formes côtelées ou
ailées. On ne peut donc pas en tirer de conclusion.
En ce qui concerne la forme ancestrale de la tige, l’analyse de parcimonie indique que la forme cylindrique était celle de l’ancêtre de la tribu, suivie par au moins 5
réversions vers des formes côtelées ou ailées. Par contre l’analyse bayésienne indique que la forme côtelée ou ailée des tiges était celle de l’ancêtre de la tribu, suivie par 3 réversions vers
des formes cylindriques chez Hatiora, Lepismium lumbricoides et Rhipsalis, avec pour ce dernier genre 3 nouvelles réversions successives vers des formes côtelées ou
ailées. On ne peut donc pas en tirer de conclusion.
● Enfin, les analyses bayésienne et de parcimonie sont contradictoires en ce qui concerne la couleur des fleurs de l’ancêtre des
Rhipsalideae : la première indique une forte probabilité pour que les fleurs aient été voyantes et colorées, alors que la seconde indique que des fleurs translucides et ternes étaient
présentes chez la forme ancestrale.
Cette analyse montre la difficulté à établir le portrait robot de l’ancêtre des Rhipsalideae (photo ci-dessus :
Hatiora salicornioides) . On peut quand même dire qu’il s’agissait d’une plante épiphyte au branchage acrotonique et déterminé, aux fleurs actinomorphes et au tube floral
court ou inexistant. Si certains caractères sont restés stables dans certaines lignées au cours de l’évolution des Rhipsalideae, d’autres caractères semblent avoir subit plusieurs
réversions au court du temps.
L'évolution des Rhipsalis
Les auteurs ont ensuite affiné leur analyse dans un second article paru en 2011, centré uniquement sur les Rhipsalis. Ils ont étudié la biogéographie des
taxons et essayé de connaitre l’apparence de l’ancêtre des Rhipsalis à partir de 4 caractères morphologiques appliqués sur les cladogrammes. Ces caractères sont :
- Les habitudes de vie : rupicole / épiphyte / rupicole et épiphyte
- La forme de la tige : angulaire avec des ailes étroites / angulaire avec des ailes larges / cylindrique
- La position de la fleur sur la tige : latérale et perpendiculaire / terminale et dans le prolongement
- La position du péricarpe sur la tige : émergé / immergé
Les conclusions suivantes sur les caractères des Rhipsalis ancestraux peuvent être tirées de ces analyses :
● La condition épiphyte est ancestrale chez les Rhipsalis, avec au moins 5 passages successifs vers des conditions rupicoles et épiphytes.
● La tige cylindrique est plus probablement la condition ancestrale des Rhipsalis. Les tiges angulaires avec de petites ailes semblent avoir évolué
plusieurs fois, alors que les ailes larges ont évolué une seule fois chez les Phyllarthrorhipsalis. La morphologie des tiges serait fortement liée au type d’habitat, mais une corrélation
stricte entre tige et habitat est difficile à établir.
● La position latérale sur la tige était le caractère de la fleur-type ancestrale des Rhipsalis, comme le montrent à la fois l’analyse bayésienne et de
parcimonie, et il y a eu une seule évolution vers une fleur terminale chez Erythrorhipsalis. Cette position de la fleur pourrait être un fort caractère sélectif, étant donné que beaucoup
de polinisateurs n’ont pas accès aux ressources florales avec des fleurs dans cette position.
● En ce qui concerne l’émergence ou non du péricarpe sur la tige de la plante ancestrale, l’analyse bayésienne indique une plus grande probabilité que le péricarpe
émerge à l’extérieur de la tige, alors que l’analyse de parcimonie n’est pas concluante. Le péricarpe en position immergée se trouve exclusivement chez le clade au péricarpe creux. Ce péricarpe
immergé pourrait être une adaptation pour la protection du fruit durant son développement, une protection contre la dessiccation du bourgeon floral, ou une adaptation à un pollinisateur.
 Les abeilles sont les principales pollinisatrices des fleurs des épiphytes des forêts pluvieuses et, sur la base de la
morphologie florale, il avait été postulé que c’est aussi le cas des Rhipsalis. Cependant les résultats de l’étude montrent qu’il existe 3 morphologies florales distinctes, chacune
correspondant à une lignée distincte, et qui indiquent que l’évolution florale a joué un rôle dans la diversification des Rhipsalis. Il y a probablement plusieurs types d’insectes
pollinisateurs chez les Rhipsalis et plusieurs stratégies reproductrices (photo à gauche : fleurs de Rhipsalis heteroclada).
Les abeilles sont les principales pollinisatrices des fleurs des épiphytes des forêts pluvieuses et, sur la base de la
morphologie florale, il avait été postulé que c’est aussi le cas des Rhipsalis. Cependant les résultats de l’étude montrent qu’il existe 3 morphologies florales distinctes, chacune
correspondant à une lignée distincte, et qui indiquent que l’évolution florale a joué un rôle dans la diversification des Rhipsalis. Il y a probablement plusieurs types d’insectes
pollinisateurs chez les Rhipsalis et plusieurs stratégies reproductrices (photo à gauche : fleurs de Rhipsalis heteroclada).
L’origine des Rhipsalis se situe dans la forêt de la côte atlantique brésilienne, les divers taxons auraient ensuite gagnés leurs positions actuelles, dont
quelques unes très éloignées en direction de la côte ouest ou de l’Amérique centrale. Le mode de dispersion n’est pas établi mais, si il s’est fait sous forme d’une migration continue au sol (et
non par transport de graines par des oiseaux), il suppose que des plantes étaient adaptées à des zones de forêt sèches lors de cette migration, ce qui est le cas de quelques taxons actuels du
genre. En tout cas la diversification des Rhipsalis semble relativement récente.
Les résultats ci-dessus montrent encore une fois, s’il en était besoin, qu’un caractère isolé peut difficilement être utilisé pour établir une classification chez
les cactées. Il conduira presque invariablement à regrouper des taxons qui n’ont pas de liens de parentés proches, ou au contraire à séparer des taxons parents. Les nombreuses réversions de
caractères que l’on observe au cours de l’évolution des cactées épiphytes pointent la nécessité de sortir d’une classification basée sur des critères purement morphologiques, et de rechercher des
critères qui n’ont pas de lien direct avec les conditions de vie des plantes.
Principales références :
Phylogenetic relationships in the cactus family (Cactaceae) based on evidence from trnK/matK and trnL-trnF sequences. Reto Nyffeler - American Journal of
Botany. (2002) 89 : 312-326.
A farewell to dated ideas and concepts: molecular phylogenetics and a revised suprageneric classification of the family Cactaceae. Nyffeler, R; Eggli, U. -
Schumannia (2010), 6:109-149.
A phylogenetic analysis of Pfeiffera and the reinstatement of Lymanbensonia as an independently evolved lineage of epiphytic Cactaceae within a new tribe
Lymanbensonieae. Korotkova, N., Zabel, L., Quandt, D., Barthlott, W. - Willdenowia (2010) 40: 151–172.
Molecular phylogeny of tribe Rhipsalideae (Cactaceae) and taxonomic implications for Schlumbergera and Hatiora. Alice Calvente, Daniela C. Zappi, Félix
Forest, Lúcia G. Lohmann - Molecular Phylogenetics and Evolution 58 (2011) 456–468.
Molecular phylogeny, evolution, and biogeography of South American epiphytic cacti. Alice Calvente, Daniela C. Zappi, Félix Forest, Lúcia G. Lohmann – Int.
J. Plant Sci., 172 (7), 902-914, 2011.
Sources iconographiques : Wikimedia et l’auteur de l’article.
 Consolea spinosissima (autrefois appelé Opuntia spinosissima) a le port caractéristique des Consolea : dans sa forme adulte il se compose d’un tronc
cylindrique et épineux avec de longues cladodes plates, elles-mêmes très épineuses, disposées tout autour du tronc comme des bras, d’ou son nom de cactus sémaphore. Il produit des
fleurs rouge orangées.
Consolea spinosissima (autrefois appelé Opuntia spinosissima) a le port caractéristique des Consolea : dans sa forme adulte il se compose d’un tronc
cylindrique et épineux avec de longues cladodes plates, elles-mêmes très épineuses, disposées tout autour du tronc comme des bras, d’ou son nom de cactus sémaphore. Il produit des
fleurs rouge orangées.



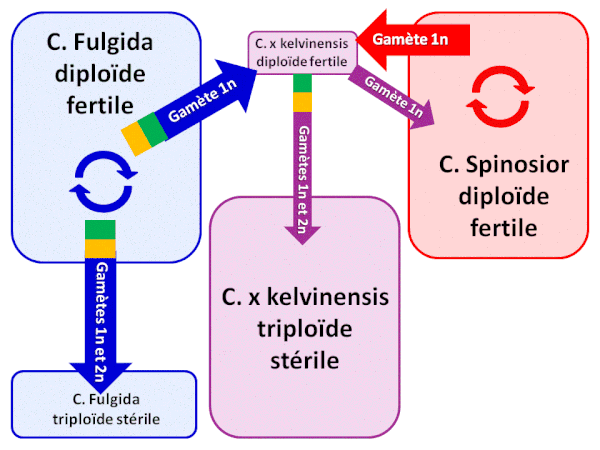
 Les plantes des populations de Florence, en Arizona, ont été largement étudiées. Au niveau morphologique, C. x
kelvinensis est une plante intermédiaire entre ses 2 espèces parentales, mais cependant d’apparence plus proche de C. spinosior que de C. fulgida. Si les individus de
C. fulgida de Florence sont relativement similaires à ceux des autres populations, les individus de C. spinosior sont différents de ceux des autres populations et ont de fortes
ressemblances avec C. x kelvinensis : tout laisse penser que les individus de C. spinosior ont récupéré des gènes de C. fulgida à travers des rétrocroisements limités avec
l’hybride C. x kelvinensis.
Les plantes des populations de Florence, en Arizona, ont été largement étudiées. Au niveau morphologique, C. x
kelvinensis est une plante intermédiaire entre ses 2 espèces parentales, mais cependant d’apparence plus proche de C. spinosior que de C. fulgida. Si les individus de
C. fulgida de Florence sont relativement similaires à ceux des autres populations, les individus de C. spinosior sont différents de ceux des autres populations et ont de fortes
ressemblances avec C. x kelvinensis : tout laisse penser que les individus de C. spinosior ont récupéré des gènes de C. fulgida à travers des rétrocroisements limités avec
l’hybride C. x kelvinensis.


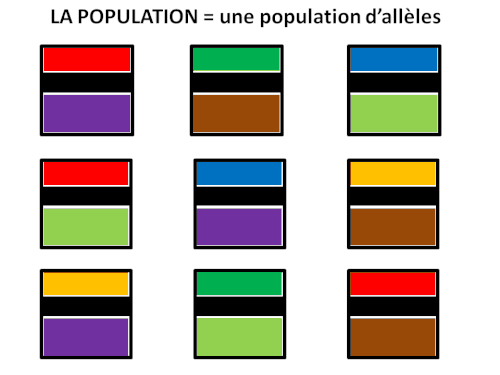
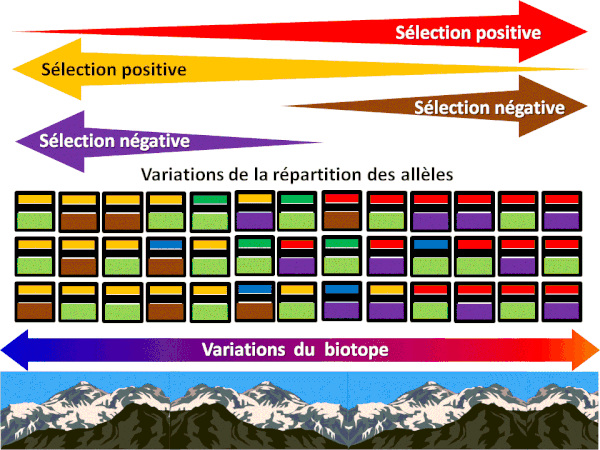
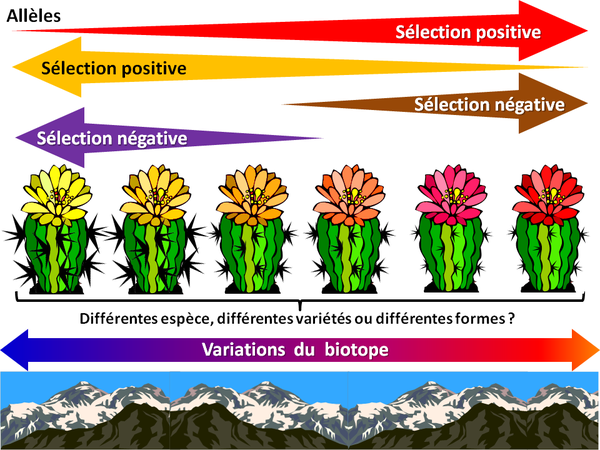
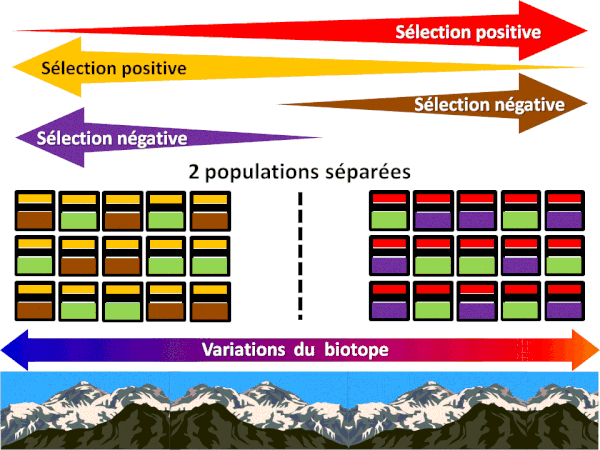
 LE CACTUS HEURISTIQUE
LE CACTUS HEURISTIQUE





























































 Les plantes du genre Pfeiffera présentent de longues tiges retombantes plates ou
côtelées, et de petites fleurs colorées ressemblant à celles des Rhipsalis ou des Hatiora (photo de gauche : Pfeiffera monacantha, anciennement
Acanthorhipsalis monacantha).
Les plantes du genre Pfeiffera présentent de longues tiges retombantes plates ou
côtelées, et de petites fleurs colorées ressemblant à celles des Rhipsalis ou des Hatiora (photo de gauche : Pfeiffera monacantha, anciennement
Acanthorhipsalis monacantha).





 Les
similarités morphologiques retrouvées entre beaucoup de cactées épiphytes ont totalement brouillé la classification. Elles résultent de très fortes convergences évolutives, qui ont amené des
plantes de lignées très distinctes à présenter des apparences très similaires, à tous les niveaux, et qui montrent qu’une classification basée sur quelques caractères morphologiques n’est pas
possible. Cette convergence évolutive est extrême pour les Lymanbensonia et Pfeiffera sensu stricto, où des plantes de 2 lignées très distinctes ont été pendant longtemps
assimilées à un même genre, alors que l’espèce Lymanbensonia incachacana est incluse dans les Lepismium (Lepismium incachacanum), tel que l’a montrée l’étude de
Korotkova et al.
Les
similarités morphologiques retrouvées entre beaucoup de cactées épiphytes ont totalement brouillé la classification. Elles résultent de très fortes convergences évolutives, qui ont amené des
plantes de lignées très distinctes à présenter des apparences très similaires, à tous les niveaux, et qui montrent qu’une classification basée sur quelques caractères morphologiques n’est pas
possible. Cette convergence évolutive est extrême pour les Lymanbensonia et Pfeiffera sensu stricto, où des plantes de 2 lignées très distinctes ont été pendant longtemps
assimilées à un même genre, alors que l’espèce Lymanbensonia incachacana est incluse dans les Lepismium (Lepismium incachacanum), tel que l’a montrée l’étude de
Korotkova et al. Les abeilles sont les principales pollinisatrices des fleurs des épiphytes des forêts pluvieuses et, sur la base de la
morphologie florale, il avait été postulé que c’est aussi le cas des Rhipsalis. Cependant les résultats de l’étude montrent qu’il existe 3 morphologies florales distinctes, chacune
correspondant à une lignée distincte, et qui indiquent que l’évolution florale a joué un rôle dans la diversification des Rhipsalis. Il y a probablement plusieurs types d’insectes
pollinisateurs chez les Rhipsalis et plusieurs stratégies reproductrices (photo à gauche : fleurs de Rhipsalis heteroclada).
Les abeilles sont les principales pollinisatrices des fleurs des épiphytes des forêts pluvieuses et, sur la base de la
morphologie florale, il avait été postulé que c’est aussi le cas des Rhipsalis. Cependant les résultats de l’étude montrent qu’il existe 3 morphologies florales distinctes, chacune
correspondant à une lignée distincte, et qui indiquent que l’évolution florale a joué un rôle dans la diversification des Rhipsalis. Il y a probablement plusieurs types d’insectes
pollinisateurs chez les Rhipsalis et plusieurs stratégies reproductrices (photo à gauche : fleurs de Rhipsalis heteroclada).




 Comme nous allons le voir, la taxonomie de Blossfeldia (photo ci-contre) a été le sujet de nombreuses
discussions. La plante constitue un cas d’école, à la fois pour illustrer les problèmes de taxonomie des cactées, mais aussi comme exemple des avancées considérables qu’ont permis les données
génétiques en matière de classification.
Comme nous allons le voir, la taxonomie de Blossfeldia (photo ci-contre) a été le sujet de nombreuses
discussions. La plante constitue un cas d’école, à la fois pour illustrer les problèmes de taxonomie des cactées, mais aussi comme exemple des avancées considérables qu’ont permis les données
génétiques en matière de classification.
 Le placement de Blossfeldia dans la seule lignée sœur des Cactoideae est contraire à d’autres classifications qui décrivaient Calymmanthium substerile comme étant
potentiellement le seul membre d’une lignée de cactées qui représente la forme ancestrale de la sous-famille ; ceci du fait que la position phylogénétique de Calymmanthium serait à
la base de l’arbre phylogénétique des Cactoideae. En 2001 Anderson place même Calymmanthium substerile, unique représentante d’un genre monospécifique, comme seul membre d’une
tribu spécifique, celle des Calymmantheae.
Le placement de Blossfeldia dans la seule lignée sœur des Cactoideae est contraire à d’autres classifications qui décrivaient Calymmanthium substerile comme étant
potentiellement le seul membre d’une lignée de cactées qui représente la forme ancestrale de la sous-famille ; ceci du fait que la position phylogénétique de Calymmanthium serait à
la base de l’arbre phylogénétique des Cactoideae. En 2001 Anderson place même Calymmanthium substerile, unique représentante d’un genre monospécifique, comme seul membre d’une
tribu spécifique, celle des Calymmantheae.
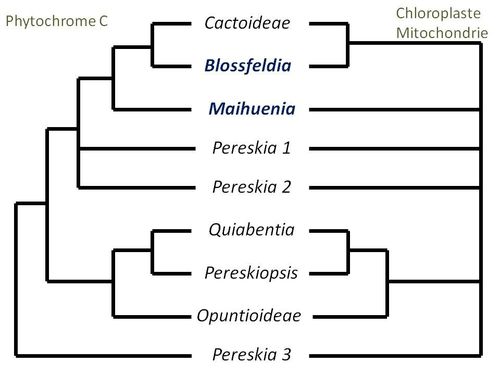
 Dans
une étude publiée en 2007, Mottram fait remarquer l’énorme ressemblance des fleurs de Blossfeldia (photo ci-dessus) avec celles des Rhipsalis et évoque une possible parenté avec
ce genre, tout en spéculant simultanément, comme Butterworth, sur le fait que Blossfeldia puisse être un membre dérivé de la sous-famille Maihuenioideae.
Dans
une étude publiée en 2007, Mottram fait remarquer l’énorme ressemblance des fleurs de Blossfeldia (photo ci-dessus) avec celles des Rhipsalis et évoque une possible parenté avec
ce genre, tout en spéculant simultanément, comme Butterworth, sur le fait que Blossfeldia puisse être un membre dérivé de la sous-famille Maihuenioideae. Assez
étrangement, la plante sous doute la plus mystérieuse de la famille des cactées est également la plus petite. En effet, Blossfeldia liliputana est un cactus presque minuscule.
Du fait de sa petite taille et de son écologie particulière, la plante n’a été découverte qu’en 1936, par le collectionneur allemand H. Blossfeld et le collectionneur argentin O. Marsoner, et
décrite en 1937 par le botaniste Werdermann. Aucun des deux collectionneurs ne se doutait que leur découverte serait la cause, 70 ans plus tard, d’autant de discussions.
Assez
étrangement, la plante sous doute la plus mystérieuse de la famille des cactées est également la plus petite. En effet, Blossfeldia liliputana est un cactus presque minuscule.
Du fait de sa petite taille et de son écologie particulière, la plante n’a été découverte qu’en 1936, par le collectionneur allemand H. Blossfeld et le collectionneur argentin O. Marsoner, et
décrite en 1937 par le botaniste Werdermann. Aucun des deux collectionneurs ne se doutait que leur découverte serait la cause, 70 ans plus tard, d’autant de discussions. Les
Les Une plante presque
astomate
Une plante presque
astomate
/idata%2F0431476%2FXerophytes-diverses%2FOthonna-clavifolia-fleur-novembre-12-2.JPG)
/idata%2F0431476%2FGymnocalycium-A-M%2FGymnocalycium-lukasikii-JPR100-237-SRA-Del-Morro-avril-13-2.JPG)
/idata%2F0431476%2FSemis%2FSemis-Echinopsis-subdenudata-4.jpg)
/idata%2F0431476%2FEuphorbiacees%2FEuphorbia-meloformis-aout-12.JPG)
/idata%2F0431476%2FCactees-epiphytes%2FHatiora-salicornioides-mars-13-6.JPG)
/idata%2F0431476%2FMonochromes%2FEuphorbia-globosa-juillet-10-5.JPG)