Je voulais revenir sur ce sujet, trop rapidement abordé dans un précédent article*. En effet, même s’il est effroyable, je trouve que c’est un des plus étonnants phénomènes biologiques qui existent.
Il y a dans le monde 2 cancers contagieux, transmissibles d’un individu à l’autre : le cancer facial du diable de Tasmanie et le cancer vénérien du chien.
Pour bien comprendre ce qui se passe avec les 2 cancers infectieux dont il va être question ci-dessous, il ne faut pas les aborder comme des curiosités ou des anomalies, et encore moins comme des maladies.
Pour bien appréhender la nature du phénomène il faut considérer les cancers contagieux comme de nouvelles espèces biologiques.
|
Qu’est-ce qu’un cancer ? |
|
Dans un organisme normal le développement des cellules est particulièrement contrôlé, à toutes sortes de niveaux. Cependant, certaines cellules échappent parfois aux règles auxquelles elles sont soumises et entament une multiplication anarchique : hors de contrôle, la multiplication cellulaire s’emballe et plus rien ne semble pouvoir l’arrêter. Ces cellules forment une tumeur, finissent par envahir un organe, débordent vers les tissus voisins, voire partent coloniser des parties distantes de l’organisme (métastases). L’émergence de ce pouvoir de multiplication anarchique a des causes multiples, essentiellement de natures génétiques : certains gènes du développement cellulaire, appelés oncogènes, habituellement réduits au silence ou parfaitement contrôlés, subissent des mutations ou des changements divers qui leur permettent de s’affranchir des contrôles qu’ils subissent. Au cours du temps les organismes ont mis en place des mécanismes variés destinés à reprendre le contrôle des cellules qui manifestent une volonté d’indépendance. Le système immunitaire est capable de reconnaitre et tuer les cellules tumorales, et des gènes anti-oncogènes ont été sélectionnés au cours de l’évolution pour bloquer la multiplication cellulaire. Mais souvent des cellules tumorales parviennent à contrer les défenses de l’organisme et à reprendre le contrôle de leur multiplication. Pourtant, la course folle des cellules cancéreuses est sans issue car la survie cellulaire à long terme ne s’envisage pas sans la survie de l’individu qui les contient : le développement incontrôlé du cancer aboutit à la mort de son hôte, et donc de ses cellules. Sauf si…. des cellules parviennent à fuir le corps avant sa destruction. |
Abordons d’abord le cancer infectieux qui est en ce moment au cœur de l’actualité du fait de la menace qu’il fait peser sur une espèce animale, c’est celui du diable de Tasmanie.
Le cancer facial du diable de Tasmanie
 Le diable
de Tasmanie, ou sarcophile (Sarcophilus harrisii), est un marsupial carnivore vivant sur l’ile de Tasmanie, au sud de l’Australie. C’est un animal au pelage noir qui ressemble à quelque
chose d’intermédiaire entre un chien et un putois (photo ci-contre). Il a un comportement assez vif, voire agressif, d’où son nom de diable.
Le diable
de Tasmanie, ou sarcophile (Sarcophilus harrisii), est un marsupial carnivore vivant sur l’ile de Tasmanie, au sud de l’Australie. C’est un animal au pelage noir qui ressemble à quelque
chose d’intermédiaire entre un chien et un putois (photo ci-contre). Il a un comportement assez vif, voire agressif, d’où son nom de diable.
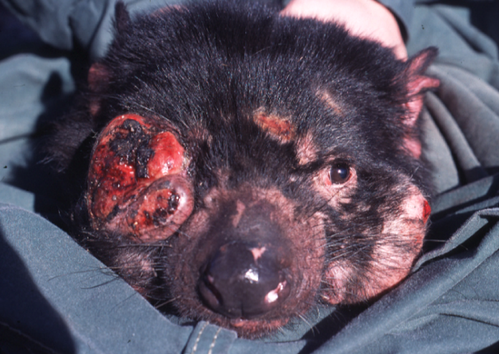
En 1996, un premier diable a été découvert à l’extrémité nord-est de l’île atteint d’un cancer de la gueule. Depuis cette date les observations de diables atteints de ce cancer se sont multipliées. Les animaux présentent des tumeurs volumineuses qui atteignent n’importe qu’elle partie de la tête (photo ci-dessous), en général proches de la gueule ou même à l’intérieur. En anglais ce cancer a été nommé Devil Facial Tumour Disease ou DFTD. Ces tumeurs ulcéreuses handicapent les animaux, qui finissent par ne plus pouvoir se nourrir et meurent en moyenne dans les 6 mois (les nombreuses photos des animaux aux têtes déformées montrent qu’ils doivent mourir dans d’atroces souffrances).
Des captures de diables effectuées sur 6 sites ont montré que le cancer se maintient à un haut niveau de prévalence dans la population : plus de 50% des animaux de 2–3-ans étaient contaminés. Aujourd’hui des zones entières de l’île ont été vidées de leurs diables par ce cancer, et au total 95% de la population de diables de l’île a disparue : l’espèce est au bord de l’extinction.
Comment un cancer découvert il y 15 ans peut-il se répandre ainsi comme une trainée de poudre ?
On sait depuis quelques temps qu’il s’agit d’un cancer contagieux, transmissible d’un individu à l’autre. C’est presque un cas unique.
Les animaux se transmettent leurs cellules tumorales par simple contact, ou en mordant un congénère au niveau de la tête, un comportement assez fréquent dans l’espèce : les animaux, habituellement solitaires, se battent fréquemment lors des rencontres ou se mordillent lors des accouplements. Ces cellules tumorales détachées de la tumeur d’un premier animal vont alors s’implanter au niveau d’une blessure et coloniser la gueule du nouvel animal pour former un nouveau cancer. Avant de mourir celui-ci transmettra à son tour les cellules cancéreuses à d’autres individus au cours de combats ou d’accouplements.
Les analyses génétiques qui ont été conduites sur les cellules cancéreuses ont montré qu’elles sont issues d’un unique diable. Ces cellules cancéreuses présentent une perte de certains chromosomes et segments chromosomiques. En 2010 il a été montré qu’il s’agit de cellules de Schwann mutées : ce sont habituellement des cellules qui gainent les nerfs des animaux.
 Cette lignée cancéreuse est née et s’est échappée d’un animal originel disparu depuis très longtemps, mais qui a laissé à la
population une lignée de cellules immortelles en guise de cadeau empoisonné.
Cette lignée cancéreuse est née et s’est échappée d’un animal originel disparu depuis très longtemps, mais qui a laissé à la
population une lignée de cellules immortelles en guise de cadeau empoisonné.
La question qui se pose est : pourquoi le système immunitaire des animaux contaminés ne reconnait pas les cellules cancéreuses comme étrangères et ne les élimine t-il pas ?
Il y a longtemps, la population de diables aurait été fortement réduite et se serait ensuite reconstituée à partir d’un faible nombre d’individus ayant des patrimoines génétiques presque identiques : de ce fait les individus de la population actuelle sont plus ou moins parents et présentent une très faible diversité génétique. Du coup le système immunitaire des individus fait très mal la différence, voire pas du tout, entre ses propres cellules et celles d’un autre individu : la réponse immunitaire contre ce cancer est très faible. Des diables du Nord-Ouest de la Tasmanie sont génétiquement différents des autres populations et résistent un peu mieux au cancer.
Il a récemment été montré que la diffusion du cancer a modifié défavorablement en quelques années la structure et la diversité génétique de la population de diables de l’île.
Le cancer vénérien du chien
 A
part le cancer du diable de Tasmanie, on ne connait qu’un seul autre cancer contagieux : le cancer vénérien du chien (dit aussi sarcome de Sticker), ou tumeur vénérienne transmissible canine
(TVTC), qui a été identifié en 1876.
A
part le cancer du diable de Tasmanie, on ne connait qu’un seul autre cancer contagieux : le cancer vénérien du chien (dit aussi sarcome de Sticker), ou tumeur vénérienne transmissible canine
(TVTC), qui a été identifié en 1876.
Ce cancer produit des tumeurs au niveau des organes génitaux des chiens, mâles et femelles, et peut parfois se propager aux ganglions voisins ou à distance. Il se transmet par contact direct de chien en chien, par transfert de cellules cancéreuses au moment de l’accouplement, au niveau de microlésions de la muqueuse génitale. Il est également transmissible par morsure ou léchage.
A la différence du cancer du diable de Tasmanie, nous avons affaire ici à un cancer contagieux bien établi et très ancien : on estime que cette lignée cancéreuse est apparue chez un canidé il y a 10 000 ans environ.
Comme le cancer du diable, on pense que ce cancer aurait évolué à l’origine dans une population consanguine de petite taille, ce qui aurait facilité la propagation des cellules sans qu’elles soient rejetées par le système immunitaire des individus. Il s’agissait sans doute d’un groupe isolé de loups, ou bien d’individus ayant vécu au moment de la domestication des loups par l’homme préhistorique, possiblement en Asie du sud-est, et qui a conduit aux chiens.
Ce cancer canin a ensuite évolué pour échapper à de plus en plus de système immunitaires différents : il est aujourd’hui capable de contaminer des races de chiens très diverses, et également des loups, des renards, des chacals et des coyotes, des animaux avec une grande diversité génétique. Ces cellules cancéreuses canines sont aneuploïdes, comme celles du diable, mais elles présentent depuis longtemps un génotype très bien stabilisé.
Le cancer infectieux du chien obéit à un autre scénario que celui du diable. Au départ les tumeurs canines restent discrètes pour échapper au système immunitaire de leurs hôtes : elles secrètent des composés inhibiteurs du système immunitaire et modulent leur propre synthèse des composés de reconnaissance immunitaire pour bloquer leur destruction par le système immunitaire de l’hôte. Mais tôt ou tard celui-ci finit par les reconnaitre comme étrangères et les détruire, ceci dans les 3 à 9 mois après l’infection : généralement le cancer vénérien du chien n’est pas mortel. Mais avant d’être détruites les cellules cancéreuses se seront propagées à un autre animal lors d’un accouplement.
Ce cancer vénérien a diffusé sur l’ensemble de la planète et contamine des chiens de tous les continents. Un échantillonnage de cellules cancéreuses de 40 chiens sur les 5 continents a montré que la lignée cellulaire cancéreuse avait divergé assez tôt en 2 sous-clades, chacun largement répandus.
Depuis que cette lignée de cellules a quitté son propriétaire initial, elle saute d’hôte en hôte dans la population comme une allogreffe. Mais son existence propre et indépendante, ainsi que sa perpétuation au cours du temps, la désignent plus comme un organisme parasite.
|
Echapper au cliquet de Muller |
|
Le cliquet est un mécanisme qui, inséré dans la denture d’une crémaillère, empêche un retour en arrière à chaque déplacement de la crémaillère. En 1964, Hermann Muller a utilisé l’image du cliquet pour expliquer comment les mutations génétiques s’accumulent dans les cellules au cours des générations. Dans une lignée biologique à reproduction asexuée, c'est-à-dire à reproduction clonale, le nombre de mutations délétères ne peut que croitre à chaque génération. Cette accumulation de mutations au cours du temps, sans possibilité de retour en arrière, c’est le cliquet de Muller. Il est postulé que la sexualité est utile pour échapper au cliquet de Muller et réparer les mutations défavorables de l’ADN : la recombinaison génétique lors de la méiose permet d’éviter l’accumulation des mutations défavorables dans une lignée, qui conduirait à la défaillance ou à la mort des organismes. Avec une espèce sexuée, deux organismes avec des mutations délétères différentes peuvent engendrer un génome sans mutation. La reproduction sexuée apparaît alors comme un moyen de réparation de l’ADN. Pourtant le cancer contagieux, qui peut être considéré comme un parasite unicellulaire à reproduction clonale, échappe au cliquet de Muller. Il n’y a actuellement pas d’explication, mais sans doute faut-il comparer les populations de cellules cancéreuses à des populations bactériennes ou virales, qui obéissent également à des règles de reproduction clonale non handicapée par le cliquet de Muller. |
Un organisme parasite qui se multiplie par clonage
Dans un cancer « classique » l’évolution cellulaire tumorale se fait toujours dans le sens d’une plus grande agressivité : au fur et à mesure que l’hôte lutte contre la tumeur celle-ci évolue également pour contrer les attaques dont elle est l’objet et renforcer sa virulence. La course engagée entre les 2 acteurs conduit inévitablement à la mort de la lignée cancéreuse, souvent du fait de la mort de son hôte.
Avec le cancer infectieux la tendance semble s’être inversée puisque, comme le montre le cancer du chien, la lignée cancéreuse peut évoluer pour trouver un « équilibre » avec son hôte. Ce type d’équilibre est habituel des relations hôte-parasite consolidées depuis longtemps.
En effet, dans les relations hôte-parasite, les 2 partenaires co-évoluent en permanence : l’hôte évolue pour contrer le parasite, et le parasite évolue pour déjouer les contre-mesures de l’hôte. C’est une course de la reine rouge qui aboutit souvent à un équilibre dynamique entre les partenaires.
Généralement une lignée de parasites n’a pas « intérêt » à être trop agressive (car des hôtes morts ne la transmettront pas) mais au contraire à ajuster finement sa virulence. Mais ce type de relation hôte-parasite presque pacifiée mets généralement du temps à s’installer, après une longue co-évolution de chacun des partenaires.
Quel espoir pour le diable ?
 Une théorie générale de la relation hôte-pathogène postule que la transmission d’un pathogène est en rapport avec la densité de son hôte : si la population des hôtes diminue un
pathogène doit donc s’éteindre avant que son hôte le fasse.
Une théorie générale de la relation hôte-pathogène postule que la transmission d’un pathogène est en rapport avec la densité de son hôte : si la population des hôtes diminue un
pathogène doit donc s’éteindre avant que son hôte le fasse.
Hélas, une étude publiée en 2009 a montré que le cancer du diable de Tasmanie n’obéit pas à cette règle de transmission du pathogène proportionnelle à la densité de l’hôte, mais à une règle de transmission fréquence-dépendante. Il s’ensuit que le cancer facial va conduire à l’extinction du diable de Tasmanie.
L’histoire du cancer vénérien des chiens donne cependant des raisons de garder espoir pour l’avenir des diables. Le cancer vénérien du chien a probablement était très agressif au moment de son apparition, mais sa perte de virulence a conduit à un équilibre avec son hôte qui lui a permis de pérenniser sa transmission dans la population de chiens.
Même si la situation du diable et de son « parasite cellulaire » est encore très déséquilibrée (elle conduit à la mort certaine et rapide des hôtes), une amorce d’évolution favorable semble s’être mise en place du fait de la très forte pression de sélection que subissent les diables. En effet, ce sont les diables qui présentent le meilleur succès reproductif face au cancer qui disséminent le mieux leurs caractères biologiques dans la population. Tous les caractères qui favoriseront le contrôle du cancer seront favorablement sélectionnés et deviendront prédominants chez ces animaux.
Il a ainsi été remarqué que le cancer a induit une sexualité des diables plus précoce dans les années qui ont suivi son apparition. Auparavant les femelles commençaient à procréer vers l’âge de 2 ans et avaient environ 3 portées au cours de leur existence. Mais le cancer a souvent réduit le nombre de portée à une seule. Les femelles qui atteignent vite leur maturité sexuelle ont la possibilité de faire une portée avant l’hiver, soit 1 an plus tôt que les autres femelles. Cette sexualité précoce favorise la possibilité d’avoir au moins une, et parfois 2 portées, avant de succomber du cancer.
On peut également penser que les populations de diables vont évoluer pour devenir moins agressives : moins de combats et moins de blessures signifieraient moins de transmission des cellules tumorales, et donc des diables qui se reproduisent plus longtemps.
Mais comme il est indiqué plus haut, les parasites subissent aussi une pression de sélection qui tend à favoriser leur dissémination. Une constante chez les parasites est la manipulation de leurs hôtes pour favoriser leur transmission.
Il a été mis en évidence que le cancer du chien - et cela rapproche ce cancer d’un vrai parasite – manipule son hôte : la tumeur déclenche la production de molécules qui augmentent la réceptivité sexuelle des femelles, ce qui augmente les accouplements et la transmission du cancer aux mâles.
En ce qui concerne le cancer des diables, il vient d’être montré que plusieurs lignées cellulaires cancéreuses sont apparues et ont évolué dans la population. On ne sait pas encore quel impact cela a sur les animaux.
Certaines évolutions de la lignée cancéreuse des diables pour favoriser sa dissémination sont prévisibles :
- sélection de caractères permettant d’augmenter l’agressivité des diables ou l’attraction sexuelle entre partenaires, comme chez le chien.
- sélection de caractères cellulaires favorisant le détachement des cellules de la tumeur,
- sélection de caractères cellulaires facilitant leur implantation dans un nouvel animal,
- et espérons, une perte de virulence qui rallonge la durée de vie de leur hôte et ainsi favorise leur dissémination au cours du temps, comme cela s’est passé avec le cancer du chien.
L’homme a également mis en place des mesures pour essayer de sauver l’espèce. En particulier des populations saines de diables ont été isolées et transférées dans des réserves en Australie.
|
Un bon modèle pour la théorie des jeux |
|
Le cancer en général, et tout autant le cancer contagieux, se prêtent particulièrement bien à une modélisation par la théorie des jeux. Le jeu du poulet (chicken game) modélise bien la situation dans laquelle se trouvent le diable et son cancer. Dans le jeu du poulet les deux adversaires sont engagés dans un conflit à l’issue duquel ils sont tous les deux condamnés si l’un d’eux ne cède pas à l’autre avant l’issue finale. Mais celui qui cède est le lâche, « le poulet » (comme situations réelles pensez à la course folle des voitures vers le précipice dans le film La fureur de vivre, ou à la crise des missiles cubains en 1962).
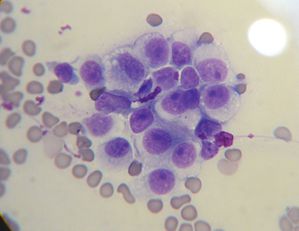
Le chien et son cancer (ci-contre les cellules cancéreuses canines) ont évolué vers un modèle faucon-colombe qui rappelle celui du dilemme du prisonnier itéré. Dans le dilemme du prisonnier les protagonistes en concurrence itérée ont intérêt à s’entendre car si chacun agit en fonction de son propre intérêt il provoque pour lui-même un résultat moins bon que ce qu’il pourrait être. Si aucun ne choisit la stratégie supposée lui apporter le gain maximum alors tous deux peuvent bénéficier d’un meilleur résultat que celui qui surviendrait sans cette contribution de chacun à un équilibre final. Le chien et son cancer seraient arrivés à une sorte d’équilibre évolutionnairement stable. Mais il y a plusieurs niveaux de modélisation possibles en théorie des jeux. L’un des modèle faucon-colombe ne considérerait les populations de diable et de chiens que comme des ressources à exploiter pour le cancer. La véritable partie mettrait en concurrence plusieurs souches de cancers, aux virulences différentes, pour lesquelles les populations de diables et de chiens ne seraient que le terrain de jeux. L’issue d’un tel jeu est beaucoup plus sombre pour les diables. |
L’universalité des cancers parasites
La prise d’indépendance de certaines cellules est-elle bien surprenante ? Non.
Une cellule obéit aux règles qui régissent le fonctionnement de tout organisme vivant : se maintenir en vie et se reproduire. A ce titre la population de cellules d’un individu obéit à la même logique de reproduction qu’une population de bactérie ou d’amibes dans un milieu de culture. Pour une cellule, augmenter son nombre de divisions procure un avantage sélectif à l’intérieur de la population de cellules avec lesquelles elle est en concurrence pour les ressources vitales. Seules des règles supérieures établies à un niveau systémique par l’organisme freinent la croissance des cellules du corps.
Pour les cellules il est payant de s’affranchir du plan de développement global auquel elles sont soumises, pour se transformer en organisme indépendant. A ce titre toute information génétique capable de promouvoir la multiplication et la diffusion cellulaire est favorablement sélectionné à un niveau local. C’est une règle universelle qui montre que l’apparition des cancers contagieux obéit à une logique imparable.
Il est tout à fait possible, et même probable, qu’il existe d’autres cancers contagieux dans le monde. Les facteurs nécessaires à l’apparition de ce type de parasite sont assez simples :
- Possibilité de contacts entre individus permettant la transmission des cellules
- Faible diversité génétique de la population, au moins au début de la diffusion du cancer, le temps que le parasite apprenne à contourner les défenses immunitaires des individus.
Ces conditions sont rarement remplies, mais il suffirait qu’elles le soient pour que les cancers infectieux deviennent fréquents.
Il est possible, et même probable, que l’apparition des cancers infectieux soit plus courante qu’on ne le croit, mais peut-être ne persistent-ils pas longtemps car ils déciment les populations infectées et meurent avec elles. L’autre possibilité correspond à la situation des chiens : du fait qu’ils ne tuent pas leurs hôtes, il est tout à fait possible que des cancers infectieux évoluent autour de nous sans que nous en ayons conscience.
***
* Le cancer du diable de Tasmanie est aussi abordé dans l’article : Les niveaux de la sélection - de la molécule à l’individu.
Principales références :
Iconographie : wikipedia.
Clonal Origin and Evolution of a Transmissible Cancer - Claudio Murgia, Jonathan K. Pritchard, Su Yeon Kim, Ariberto Fassati, Robin A. Weiss - Cell, Volume 126, Issue 3, 11 August 2006.
Origins and Evolution of a Transmissible Cancer - Clare A. Rebbeck, Rachael Thomas, Matthew Breen, Armand M. Leroi, Austin Burt – Evolution, Volume 63, Issue 9, September 2009.
Evidence that disease-induced population decline changes genetic structure and alters dispersal patterns in the Tasmanian devil – Lachish S. et al. - Heredity, volume 106, 2011.
Genetic diversity and population structure of the endangered marsupial Sarcophilus harissii (Tasmanian devil) – Miller W. et al. – PNAS, volume 108, 2011.
Transmission dynamics of Tasmanian devil facial tumor disease may lead to disease-induced extinction – Mc Callum H. et al. – Ecology, volume 90, 2009.
 LE CACTUS HEURISTIQUE
LE CACTUS HEURISTIQUE
 Dans la course folle engagée entre la population de diables et celle des cellules cancéreuses, l’issue finale ne
fait aucun doute : l’extinction des deux populations. La population qui « cédera » à l’autre, c'est-à-dire celle qui baissera sa fitness pour sauver son avenir, sauvera
également l’avenir de l’autre population par contrecoups. L’exemple du cancer du chien laisse espérer que c’est ce qui se passera.
Dans la course folle engagée entre la population de diables et celle des cellules cancéreuses, l’issue finale ne
fait aucun doute : l’extinction des deux populations. La population qui « cédera » à l’autre, c'est-à-dire celle qui baissera sa fitness pour sauver son avenir, sauvera
également l’avenir de l’autre population par contrecoups. L’exemple du cancer du chien laisse espérer que c’est ce qui se passera.

 La pyrale du maïs
(Ostrinia nubilalis) est un petit papillon beige qui est apparu en Europe Occidentale il y a environ 5 siècles.
La pyrale du maïs
(Ostrinia nubilalis) est un petit papillon beige qui est apparu en Europe Occidentale il y a environ 5 siècles. La pyrale du maïs, qui serait donc apparue par changement d’hôte, a du faire face à un nouvel environnement, avec son cortège de prédateurs et de dangers. Le traitement agricole du maïs
constitue le premier danger pour l’insecte. Depuis la généralisation de l'utilisation des moissonneuses-batteuses la partie supérieure des cannes de maïs, complètement broyées au moment de la
récolte des épis, est devenue un refuge mortel pour les chenilles.
La pyrale du maïs, qui serait donc apparue par changement d’hôte, a du faire face à un nouvel environnement, avec son cortège de prédateurs et de dangers. Le traitement agricole du maïs
constitue le premier danger pour l’insecte. Depuis la généralisation de l'utilisation des moissonneuses-batteuses la partie supérieure des cannes de maïs, complètement broyées au moment de la
récolte des épis, est devenue un refuge mortel pour les chenilles.
 Le
crépis de Nîmes (Crepis sancta) est une petite plante annuelle aux fleurs jaunes, proche des pissenlits, qui a la particularité de produire 2 types de graines, en proportions
différentes : une majorité de graines ailées à aigrettes qui sont dispersées au loin par le vent et une minorité de graines plus grosses, qui tombent au pied de la plante et germent
là.
Le
crépis de Nîmes (Crepis sancta) est une petite plante annuelle aux fleurs jaunes, proche des pissenlits, qui a la particularité de produire 2 types de graines, en proportions
différentes : une majorité de graines ailées à aigrettes qui sont dispersées au loin par le vent et une minorité de graines plus grosses, qui tombent au pied de la plante et germent
là. Les oiseaux des villes sont confrontés à des habitats qui sont très différents de ceux qu’ils auraient à côtoyer à la campagne. Des paramètres importants auxquels ils
sont confrontés sont le bruit et l’éclairage de la ville. Comment ces paramètres influent-ils sur le chant des oiseaux, qui est un déterminant essentiel pour la séduction du partenaire
sexuel et la défense du territoire ?
Les oiseaux des villes sont confrontés à des habitats qui sont très différents de ceux qu’ils auraient à côtoyer à la campagne. Des paramètres importants auxquels ils
sont confrontés sont le bruit et l’éclairage de la ville. Comment ces paramètres influent-ils sur le chant des oiseaux, qui est un déterminant essentiel pour la séduction du partenaire
sexuel et la défense du territoire ? La Nouvelle-Zélande est un
territoire qui s’est détaché de l’Australie et de l’Antarctique quand le supercontinent Gondwana s’est fragmenté il y a 80 millions d’années. En plus de ses 2 grandes îles, elle constitue un
archipel de 700 îles qui se caractérise par la très haute endémicité de sa faune, liée à son caractère insulaire et son long isolement.
La Nouvelle-Zélande est un
territoire qui s’est détaché de l’Australie et de l’Antarctique quand le supercontinent Gondwana s’est fragmenté il y a 80 millions d’années. En plus de ses 2 grandes îles, elle constitue un
archipel de 700 îles qui se caractérise par la très haute endémicité de sa faune, liée à son caractère insulaire et son long isolement. 1894 : les autorités s’alarment de la raréfaction croissante de cette espèce emblématique : 300 à 400 individus sont alors capturés et transférés sur une île du Fiorland
dépourvue de prédateurs. Hélas, dans les années qui suivent des hermines envahissent l’île et dés 1900 toute la population de kakapos transférée est décimée !
1894 : les autorités s’alarment de la raréfaction croissante de cette espèce emblématique : 300 à 400 individus sont alors capturés et transférés sur une île du Fiorland
dépourvue de prédateurs. Hélas, dans les années qui suivent des hermines envahissent l’île et dés 1900 toute la population de kakapos transférée est décimée ! 1995 :
il s’avère que sur les ilots refuges les rats exercent une prédation sur les œufs et concurrencent les kakapos pour les ressources alimentaires. Seuls 12 poussins sont nés depuis le transfert et
3 ont survécu. La population totale a chuté à 51 individus, avec un fort déficit en femelles. Un nouveau plan d’action décennal est mis en place.
1995 :
il s’avère que sur les ilots refuges les rats exercent une prédation sur les œufs et concurrencent les kakapos pour les ressources alimentaires. Seuls 12 poussins sont nés depuis le transfert et
3 ont survécu. La population totale a chuté à 51 individus, avec un fort déficit en femelles. Un nouveau plan d’action décennal est mis en place.
 Le nourrissage artificiel
des oiseaux sur leurs 2 îles avait eu un effet positif sur leur santé : le poids des femelles avait augmenté de 15% et leur succès reproductif s’était amélioré (une plus haute proportion
d’œufs ont donné naissance à des poussins). Cependant la fréquence de reproduction n’avait pas augmenté et un fort déséquilibre du sex-ratio en faveur des mâles s’était installé.
Le nourrissage artificiel
des oiseaux sur leurs 2 îles avait eu un effet positif sur leur santé : le poids des femelles avait augmenté de 15% et leur succès reproductif s’était amélioré (une plus haute proportion
d’œufs ont donné naissance à des poussins). Cependant la fréquence de reproduction n’avait pas augmenté et un fort déséquilibre du sex-ratio en faveur des mâles s’était installé. 2003 :
la population s’élevait à 85 individus, soit une hausse de 68% depuis 1995, et avec une proportion importante de femelles.
2003 :
la population s’élevait à 85 individus, soit une hausse de 68% depuis 1995, et avec une proportion importante de femelles. Un problème mineur
Un problème mineur  Le problème posé par la sexualité est très simple, voire évident. A la différence de la multiplication asexuée, la reproduction sexuée a un coût majeur - énorme - pour les espèces qui
doivent l'utiliser pour se reproduire : elle engendre la moitié des individus d'une population - les mâles - pour rien, puisque seules les femelles sont en charge de produire la descendance,
et utilisent les ressources à cette fin.
Le problème posé par la sexualité est très simple, voire évident. A la différence de la multiplication asexuée, la reproduction sexuée a un coût majeur - énorme - pour les espèces qui
doivent l'utiliser pour se reproduire : elle engendre la moitié des individus d'une population - les mâles - pour rien, puisque seules les femelles sont en charge de produire la descendance,
et utilisent les ressources à cette fin. Cette hypothèse pourrait expliquer l'apparition de la sexualité sur terre.
Cette hypothèse pourrait expliquer l'apparition de la sexualité sur terre. L'idée de la nécessité de la variabilité des organismes a au départ été formulée par August Weismann en 1889. C'est l'hypothèse « classique », qui suppose qu'un brassage génétique
serait indispensable à chaque génération pour assurer une variabilité génétique. C'est une hypothèse reprise par Hermann Muller en 1932, qui note que mutations et reproduction seraient
indispensables pour que les organismes restent adaptés à un environnement en constante évolution.
L'idée de la nécessité de la variabilité des organismes a au départ été formulée par August Weismann en 1889. C'est l'hypothèse « classique », qui suppose qu'un brassage génétique
serait indispensable à chaque génération pour assurer une variabilité génétique. C'est une hypothèse reprise par Hermann Muller en 1932, qui note que mutations et reproduction seraient
indispensables pour que les organismes restent adaptés à un environnement en constante évolution. Le principe du cliquet de Muller est le pendant de l'explication précédente et reprends le principe d'une sexualité utile pour réparer l'ADN. En effet, la recombinaison génétique issue de
la sexualité a un autre effet avantageux, elle permet d'éviter l'accumulation des mutations défavorables dans une lignée, comme cela peut se produire avec la reproduction
asexuée.
Le principe du cliquet de Muller est le pendant de l'explication précédente et reprends le principe d'une sexualité utile pour réparer l'ADN. En effet, la recombinaison génétique issue de
la sexualité a un autre effet avantageux, elle permet d'éviter l'accumulation des mutations défavorables dans une lignée, comme cela peut se produire avec la reproduction
asexuée. Le grand biologiste
Le grand biologiste  Cette hypothèse complète et renforce celle ci-dessus de Hamilton, et propose une explication à la divergence entre mâle et femelle. Cette théorie, que beaucoup considérèrent comme
extravagante à l'époque de sa formulation, est aujourd'hui considérée comme plausible.
Cette hypothèse complète et renforce celle ci-dessus de Hamilton, et propose une explication à la divergence entre mâle et femelle. Cette théorie, que beaucoup considérèrent comme
extravagante à l'époque de sa formulation, est aujourd'hui considérée comme plausible. Il
est connut que les génomes de tous les organismes sont envahis de séquences d'ADN parasites. Pour envahir des populations, de tels éléments parasites ont besoin que les cellules fusionnent entre
elles, sinon ils sont condamnés à rester cloitrés dans des générations de clones. D. Hickey, de l'Université d'Ottawa, pense que la fusion de 2 cellules lors de la reproduction pourrait avoir été
initiée par ces ADN parasites : un gène parasite capable de provoquer, par un moyen ou un autre, la fusion de 2 cellules verra sa diffusion augmenter dans une population et sera favorisé par
rapport à un ADN parasite qui n'en est pas capable. Cet ADN parasite serait à l'origine de la fécondation et, de là, de la sexualité toute entière. Hickley suppose que les cellules hôte du
parasite, devenues haploïdes, ont plus tard inventé la méiose pour redonner des individus haploïdes à un seul lot de chromosomes : les gamètes.
Il
est connut que les génomes de tous les organismes sont envahis de séquences d'ADN parasites. Pour envahir des populations, de tels éléments parasites ont besoin que les cellules fusionnent entre
elles, sinon ils sont condamnés à rester cloitrés dans des générations de clones. D. Hickey, de l'Université d'Ottawa, pense que la fusion de 2 cellules lors de la reproduction pourrait avoir été
initiée par ces ADN parasites : un gène parasite capable de provoquer, par un moyen ou un autre, la fusion de 2 cellules verra sa diffusion augmenter dans une population et sera favorisé par
rapport à un ADN parasite qui n'en est pas capable. Cet ADN parasite serait à l'origine de la fécondation et, de là, de la sexualité toute entière. Hickley suppose que les cellules hôte du
parasite, devenues haploïdes, ont plus tard inventé la méiose pour redonner des individus haploïdes à un seul lot de chromosomes : les gamètes./idata%2F0431476%2FXerophytes-diverses%2FOthonna-clavifolia-fleur-novembre-12-2.JPG)
/idata%2F0431476%2FGymnocalycium-A-M%2FGymnocalycium-lukasikii-JPR100-237-SRA-Del-Morro-avril-13-2.JPG)
/idata%2F0431476%2FSemis%2FSemis-Echinopsis-subdenudata-4.jpg)
/idata%2F0431476%2FEuphorbiacees%2FEuphorbia-meloformis-aout-12.JPG)
/idata%2F0431476%2FCactees-epiphytes%2FHatiora-salicornioides-mars-13-6.JPG)
/idata%2F0431476%2FMonochromes%2FEuphorbia-globosa-juillet-10-5.JPG)